肿瘤是威胁人类健康的重要疾病,细胞免疫疗法正为抗肿瘤免疫治疗带来新的希望。在免疫细胞抗肿瘤治疗中,CD4+ T细胞可以通过发育分化为效应性Th1、Th2、Th17和具有免疫抑制作用的调节性T细胞(regulatory T cells; Treg)等发挥重要的调控作用。树突状细胞(dendritic cells; DCs)是专职的抗原提呈细胞,在调控不同亚群T细胞分化中发挥关键作用,并最终将决定免疫应答的结局。然而,在肿瘤微环境中,天然免疫细胞(如DCs)调控CD4+ T细胞功能分化的机制,目前仍然不清楚。
肿瘤微环境对肿瘤生长非常重要。而肿瘤微环境中的天然刺激是多种多样的,炎症刺激、机械力刺激等常混合存在。是否炎症和机械力刺激在调控先天免疫细胞(如DC)应答方面发挥调控作用,一直是研究者关注的科学问题。然而,尚不清楚DC的Piezo1信号是否影响肿瘤微环境中不同T细胞亚群的功能分化。
2022年8月22日,565net必赢刘光伟教授团队、复旦大学杨慧副教授、军事医学研究院毕玉晶研究员团队合作在eLife发表了题为“Dendritic cell Piezo1 directs the differentiation of Th1 and Treg cells in cancer”的研究论文。该研究发现,由机械力或炎症信号刺激的DC机械传感器Piezo1在抑制肿瘤生长中调节Th1和Treg细胞的相互分化。这项研究为理解基于DC的免疫病理学机械调节在指导肿瘤微环境中的T细胞谱系分化中的作用提供新思路。

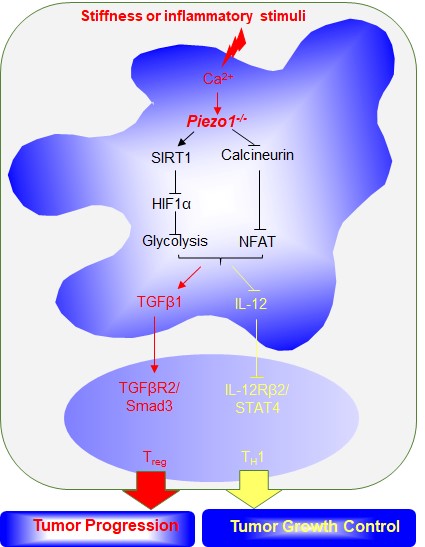
该研究采用Piezo1特异性DC缺失小鼠(Piezo1-/-),发现Piezo1-/-小鼠肿瘤生长更快和更大。而且,肿瘤局部浸润T细胞中Th1细胞浸润减少而Treg细胞浸润增多。采用体内外实验,发现炎症或者机械力刺激获得的Piezo1缺失的DC可以明显调节Th1和Treg细胞分化,且主要是通过改变DC细胞IL-12和TGFβ1分泌实现。有趣的是,肿瘤局部给与IL-12和抗TGFβ抗体处理对小鼠肿瘤具有明显的治疗效应。这说明,靶向DC的Piezo1信号通过干预细胞因子分泌可以通过改变T细胞亚群分化并调节肿瘤局部微环境而影响肿瘤生长。进一步,炎症和机械力刺激可以明显改变人外周血来源DC的Piezo1表达。通过激动剂上调DC的Piezo1表达,可以调节人的Th1和Treg分化,表明该信号途径可能为临床靶向DC的T细胞分化干预肿瘤免疫治疗研究提供新策略。
这项研究采用多种转基因小鼠结合细胞生物学和分子生物学技术发现机械力受体Piezo1在DC介导的T细胞亚群分化中发挥调控作用并在抗肿瘤免疫治疗中具有临床应用前景。肿瘤微环境中多种不同类型刺激混合存在,炎症和机械力刺激等都可能改变免疫应答结局,本研究揭示炎症和机械力等刺激可以在DC指导的T细胞亚群分化中发挥关键作用,这为更全面理解肿瘤免疫微环境提供了实验依据。另外,本研究还对Piezo1调控DC细胞因子分泌的机制进行了深入研究,发现Piezo1可以整合SIRT1-HIF1α-糖代谢信号途径结合钙离子信号-钙调蛋白-核转录因子NFAT信号途径调控DC细胞因子分泌(下图)。这也说明,离子通道Piezo1在炎性和机械力刺激应答的条件下,可以整合细胞环境中离子浓度和代谢信号变化,改变其功能,最终调控T细胞不同亚群分化,在决定疾病结局中发挥重要作用。虽然该论文揭示了一些肿瘤免疫微环境的调控机制,但也显示肿瘤微环境调控机制的复杂性,进一步深入解析肿瘤免疫微环境调控规律,可以为细胞免疫治疗策略研究提供新思路。
565net必赢刘光伟教授和军事医学研究院毕玉晶研究员是本文的共同通讯作者。565net必赢王悦心博士生、复旦大学杨慧副教授、565net必赢贾安娜博士、王宇飞博士生和杨秋立博士生等为本文的共同第一作者。该工作得到了国家自然科学基金重点项目(31730024)和面上项目(32170911和31970863)及北京市自然基金面上项目(5202013)等资助。
原文链接:https://elifesciences.org/articles/79957