2020年12 月24日,国际顶级学术期刊Nature(《自然》)在线发表了565net必赢王占新实验室与南方科技大学的冷冻电镜中心、美国斯隆凯特琳癌症研究所的Dinshaw Patel实验室以及美国斯坦福大学的Or Gozani实验室合作完成的题为“Molecular basis of nucleosomal H3K36 methylation by NSD methyltransferases”的学术论文,首次揭示了NSD家族组蛋白赖氨酸甲基转移酶修饰核小体的分子机理,并探讨了该家族蛋白突变与人类癌症的关系。
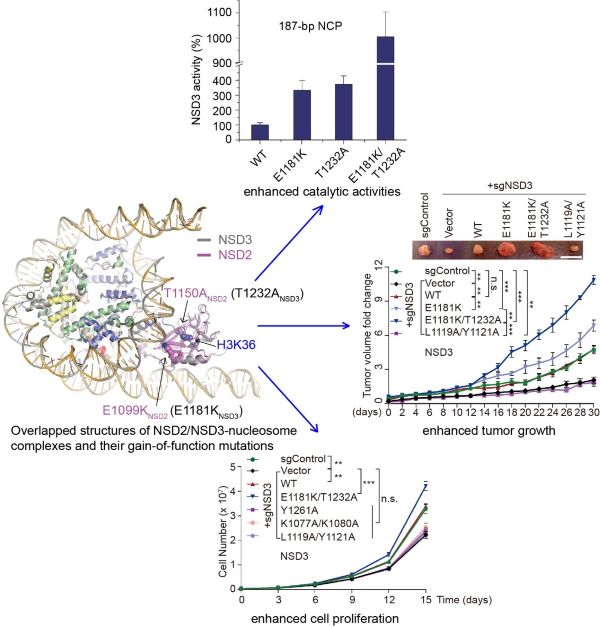
人源NSD家族蛋白包括NSD1、NSD2和NSD3三个成员,都是组蛋白H3第36位赖氨酸的二甲基转移酶。NSD家族蛋白调控染色质结构,是重要的表观遗传调控因子,在高等动物细胞中发挥重要的生理功能,其成员的异常表达或者突变与人类多种癌症相关,比如NSD3与急性白血病和头颈癌等相关,NSD2与人类的多发性骨髓瘤以及Wolf-Hirschhorn综合征等疾病相关,目前还没有针对该家族蛋白的特效药。该工作解析了NSD3和NSD2与核小体复合物较高分辨率的冷冻电镜结构,发现NSD2和NSD3倾向于结合含有linker DNA的核小体。NSD2或NSD3解离核小体核心颗粒出口或入口处缠绕的DNA,其催化结构域结合在核小体核心组蛋白与解离的DNA之间,通过与核小体DNA和组蛋白一系列位点特异的相互作用得到激活并发挥H3K36位点的甲基转移酶活性。这些与核小体位点特异的相互作用使得NSD蛋白的催化结构域以较为伸展的构象结合在核小体上,使得含有H3K36位点的组蛋白尾巴能够结合在催化位点并激活NSD蛋白。该工作进一步发现几个癌症相关的NSD2和NSD3突变,例如NSD2的E1099K和T1150A突变,以及这两个突变在NSD3中对应的E1181K和T1232A突变,都会分别增强NSD2或NSD3的催化活性,促进癌细胞的增殖并促进移植瘤在裸鼠体内的生长。结构分析表明NSD2的E1099K突变及其对应的NSD3的E1181K突变虽然远离组蛋白H3的催化位点,但是该突变会通过增强NSD蛋白与核小体DNA的相互作用来增强其催化活性。NSD3的T1232A突变靠近组蛋白H3K36的结合位点,该突变会增强组蛋白尾巴与催化结构域结合的稳定性以增强其催化活性。综上,该工作首次揭示了NSD家族蛋白以核小体为底物催化组蛋白甲基化的分子机制,以及其癌症相关突变可能致病的分子机理,为进一步理解NSD家族蛋白的生理功能以及靶向NSD家族蛋白的药物研发提供重要分子基础。